Problem otyłości i związanych z nią zaburzeń metabolicznych urasta do rangi epidemii. Problemy z nadmierną masą ciała są powszechne już w wieku dziecięcym, a z cukrzycą typu 2 zmaga się obecnie ponad 422 milionów ludzi na świecie. Poza uwarunkowaniem genetycznym do rozwoju otyłości w głównej mierze przyczynia się nieprawidłowy styl życia (nadmierna, bogatokaloryczna dieta wraz z siedzącym trybem życia), zaburzenia endokrynologiczne czy stosowane leki. Czy probiotyki mogą być wsparciem w walce z otyłością?
Publikacje ostatnich lat wskazują, że znaczącą rolę w rozwoju otyłości może odgrywać mikrobiota jelitowa, której skład zmienia się u osób z otyłością. Przypisywany mikroorganizmom jelitowym potencjał metaboliczny, a także udział w regulacji procesów energetycznych i przyswajaniu energii z pożywienia sprawił, że stały się ona przedmiotem wielu badań nad rozwojem nadwagi i otyłości. Czy modulacja mikrobioty poprzez celowaną probiotykoterapię może przyczynić się do regulacji masy ciała i przemian metabolicznych? Sprawdźmy, co mówią badania w 2022 roku.
Otyłość a mikrobiota jelitowa
Otyłość jest przewlekłą chorobą występującą na całym świecie, szczególnie w krajach wysoko rozwiniętych. Choć w rozwoju tego schorzenia ma udział genetyka, to zdecydowaną rolę odgrywają tutaj czynniki środowiskowe. Kształtowanie się mikrobioty jest procesem towarzyszącym nam od momentu przyjścia na świat, a niektóre publikacje wskazują wręcz, że programowanie mikrobioty może mieć swój początek jeszcze w życiu płodowym [1, 2].
To, jak będzie kształtowała się nasza mikrobiota, zależy od wielu czynników, w tym: sposobu porodu i karmienia niemowlęcia czy stosowania antybiotyków w okresie okołoporodowym. Wiele badań wskazuje, że zarówno cięcie cesarskie, jak i antybiotykoterapia we wczesnym okresie życia mogą zwiększać ryzyko wystąpienia otyłości w wieku przedszkolnym nawet dwukrotnie. Z kolei w dorosłym życiu dużą rolę w patogenezie odgrywają nieprawidłowe nawyki żywieniowe, niska aktywność fizyczna, stres oraz inne niekorzystne czynniki psychospołeczne [1, 3].
Chroniczny stres, który jest nieodzownym elementem naszego współczesnego życia, prowadzi do nadmiernej aktywności osi podwzgórze-przysadka-nadnercza i zbyt dużych wyrzutów kortyzolu. Pokłosiem takiego stanu rzeczy jest spożywanie pokarmów w nadmiarze (zwłaszcza produktów bogatych w cukry proste i tłuszcze), a także zwiększona konsumpcja alkoholu. Powyższe czynniki mocno destabilizują mikrobiotę jelitową i pogarszają jej kondycję. Już 10 dni “przemysłowej diety” może zmniejszać różnorodność mikrobioty nawet o 40%! W świetle aktualnych badań modulacja mikrobioty poprzez odpowiednią dietę oraz celowaną probiotykoterapię może wpływać na poprawę przemian metabolicznych, a tym samym zmniejszać ryzyko nadwagi i otyłości oraz chorób cywilizacyjnych.
Już 10 dni “przemysłowej diety” może zmniejszać różnorodność mikrobioty nawet o 40%.
W jaki sposób mikrobiota jest powiązana z rozwojem chorób o podłożu zapalnym?
Prace badawcze ostatnich lat wyraźnie wskazują, że zmiany jakościowe i ilościowe w obrębie mikrobioty (tzw. dysbioza) są zaangażowane w rozwój zaburzeń metabolicznych i chorób przewlekłych: cukrzycy typu 2, alergii, otyłości, chorób neurodegeneracyjnych czy depresji. Problem dysbiozy jest powszechny w XXI wieku z uwagi na wiele czynników:
- “western diet”, czyli tzw. model diety zachodniej obfitujący w cukry proste, tłuszcze trans, białko zwierzęce, a jednocześnie ubogi w błonnik i cenne w warzywach i owocach polifenole zasilające mikrobiotę.
- stosowanie leków, zwłaszcza przeciwzapalnych (NLPZ), osłonowych na żołądek (IPP), antybiotyków, preparatów żelaza czy doustnej antykoncepcji hormonalnej,
- przewlekły stres, który destabilizuje mikrobiotę,
- przebyte infekcje.
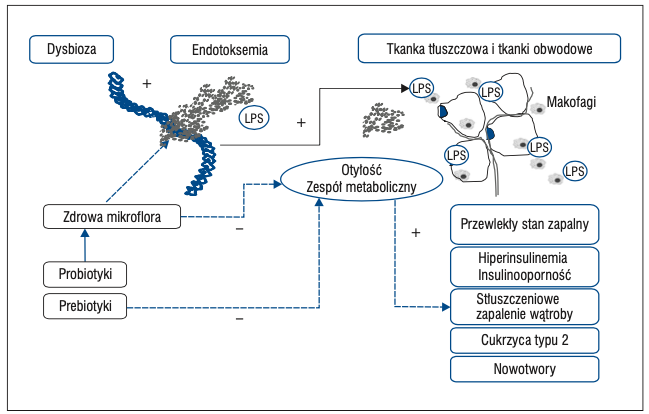
Mikroorganizmy zasiedlające jelito mocno regulują funkcje układu immunologicznego, hormonalnego i nerwowego, są także zaangażowane w utrzymanie prawidłowej struktury i funkcji bariery jelitowej. Jednym z mechanizmów, który może przyczyniać się do rozwoju otyłości jest zwiększona przepuszczalność bariery jelitowej dla mikroorganizmów, antygenów i szkodliwych substancji do organizmu, m.in. lipopolisacharydu bakteryjnego (LPS, ang. bacterial lipopolysaccharide). Jest to składnik ściany komórkowej bakterii Gram-ujemnych oraz cyjanobakterii, które bytują w przewodzie pokarmowym.
Podwyższone stężenie LPS będące wynikiem diety wysokotłuszczowej przyczynia się do rozwoju stanu zapalnego o niskim stopniu nasilenia, który sprzyja rozwojowi chorób cywilizacyjnych. Ponadto dysbioza upośledza także syntezę białek odpowiadających za integralność bariery jelitowej (zonuliny i okludyny). Mikrobiota patologiczna powoduje także zwiększenie gęstości naczyń włosowatych w nabłonku jelita, co zwiększa objętość i szybkość wchłaniania monosacharydów [4, 5].
Rozwój stanu zapalnego ciągnie za sobą kolejne konsekwencje metaboliczne. Badania wskazują, że wraz z trwającym zapaleniem u osób otyłych występują wyższe poziomy hormonu leptyny pełniącej obowiązki „kontrolera” energetyki organizmu i wydzielanej głównie przez adipocyty (komórki tkanki tłuszczowej). Leptyna wysyła do mózgu (a dokładniej neuronów w podwzgórzu) informacje o sytości lub głodzie, regulując tym samym apetyt i masę ciała. Wzrost stężenia leptyny to sygnał, że jesteśmy najedzeni i można „podkręcić metabolizm”, z kolei niskie jej poziomy oznaczają wzmożony głód i spowolnienie przemian energetycznych [6].
Im więcej tkanki tłuszczowej, tym większy poziom leptyny.
Jednak chronicznie podwyższony poziom leptyny, obserwowany w otyłości, prowadzi do zjawiska „leptynooporności”. Oznacza to, że wysokie poziomy leptyny upośledzają sygnalizację na osi głód-sytość i zamiast hamować głód prowadzą paradoksalnie do jego niepohamowanego pobudzenia. Prawdopodobnie wynika to z utrudnionego przechodzenia leptyny przez barierę krew-mózg i/lub z zahamowania wewnątrzkomórkowego szlaku sygnalizacyjnego leptyny. Co ciekawe, istnieją badania wskazujące, że to nie tylko nadmiar tkanki tłuszczowej, ale niektóre bakterie wpływają na zakłócenia w wytwarzaniu leptyny [6, 7].
Ponadto podwyższony poziom leptyny promuje wydzielanie cytokin prozapalnych oraz prowadzi do zmniejszonej produkcji acetylocholiny, czego wynikiem jest utrzymujący się stan zapalny i spowolniona perystaltyka jelit [7].
Mikrobiota “otyła” versus “szczupła”
Badania na myszach dowiodły, że przeszczep mikrobioty z osobników otyłych na te ze “sterylnym” przewodem pokarmowym (ang. germ free, czyli pozbawione mikroorganizmów jelitowych) spowodował u nich większy przyrost masy ciała niż w sytuacji transplantacji mikrobioty od myszy szczupłych. W innym badaniu podawanie myszom LPS (ang. bacterial lipopolysaccharide) przez 4 tygodnie przyczyniło się do rozwoju stanu zapalnego, a także przyrostu masy ciała oraz wzrostu stężenia glukozy, trójglicerydów i nasilenia insulinooporności [2].
Badania z udziałem ludzi niejako potwierdziły te obserwacje. Skład mikrobioty osób otyłych różni się od mikrobioty osób szczupłych. U osób z nadmierną masą ciała przeważa rodzaj bakterii Firmicutes, a szczególnie klasy Mollicutes, zdolnej do wydajniejszego pozyskiwania energii z pożywienia [4].
20-procentowy wzrost liczby Firmicutes i analogiczny spadek liczby Bacteroidetes odpowiada za zwiększenie o 150 kcal poboru energii z pożywieniem.
[4]
Ponadto w stolcu osób otyłych stwierdza się większą ilość krótkołańcuchowych kwasów tłuszczowych (SCFA, short chain fatty acids), tj. masłowego, octowego, propionowego. Choć są to związki działające odżywczo na kolonocyty, ich nadmierne stężenie nie jest korzystne. Może zwiększać przyswajanie energii z pożywienia i przyczyniać się do wzrostu bilansu kalorycznego (m.in. poprzez stymulację peptydu YY) i zwolnionej motoryki jelit [5].
Dlatego, aby zachowanie równowagi przemian metabolicznych i optymalnego pozyskiwania energii z pożywienia zapewnia nam zróżnicowana mikrobiota jelitowa. Im większa więc różnorodność panuje w jelitowym ekosystemie, tym lepiej się to odbija na naszym zdrowiu.
Dieta promująca różnorodną mikrobiotę
Kluczowy wpływ na jakość mikrobioty ma zróżnicowana dieta i codzienne zwyczaje i rutyny. Postęp cywilizacyjny, a przez to wysoki stopień przetworzenia pokarmów spowodował znaczne zubożenie i zmniejszenie różnorodności jelitowego ekosystemu. Popularne diety redukcyjne prowadzą bardzo często do pogłębienia tego problemu, np. jadłospisy wysokobiałkowe przy jednocześnie niskiej podaży węglowodanów prowadzą do niedoboru bifidobakterii [8]. Ponadto może się to wiązać z potencjalnie negatywnymi skutkami zdrowotnymi z powodu zwiększonej fermentacji bakteryjnej niestrawionego białka w okrężnicy i późniejszych zmian w składzie mikrobioty jelitowej. Zmiany w składzie populacji drobnoustrojów jelitowych i ich aktywności przekładają się na zdrowie gospodarza [9].
Jakie pokarmy są szczególnie korzystne dla różnorodnej mikrobioty? Od lat w rankingu na najzdrowsze diety niezmiennie królują modele przeciwzapalne, w tym popularna dieta śródziemnomorska. Produkty sprzyjające zdrowej, a więc różnorodnej mikrobiocie to przede wszystkim pokarmy roślinne, czyli baza diety śródziemnomorskiej czy DASH (ang. Dietary Approaches to Stop Hypertension). Zawarte w nich polifenole oraz błonnik pokarmowy zasilają populację mikrobów jelitowych.
W naszej diecie nie może zabraknąć witamin: A, D, E, a także cynku, które wpływają na zachowanie szczelnej bariery jelitowej. Korzystne działanie przypisuje się także kurkuminie oraz katechinom zawartym w zielonej herbacie.
Warzywa i owoce to produkty, których korzystny wpływ na mikrobiotę jest powszechnie znany. Warto pamiętać, że wartościowym paliwem dla różnorodnej mikrobioty są także zdrowe tłuszcze z orzechów, awokado, oliwy czy tłustych ryb morskich (kwasy tłuszczowe omega-3). Dobrym nawykiem może okazać się popijanie zielonej herbaty – zawarte w niej katechiny, m.in. EGCG (galusan epigalokatechiny), zwiększają różnorodność mikrobiologiczną. W jadłospisie nie powinno także zabraknąć kasz gruboziarnistych, pełnego ziarna, kiszonek, pestek i nasion. Ważnym elementem dietoterapii może okazać się suplementacja probiotyczna, która poprzez modulację mikrobioty jelitowej wpłynie na poprawę przemian metabolicznych [10].
Probiotyki a nadmierna masa ciała
Cennym uzupełnieniem zróżnicowanej diety może okazać się celowana probiotykoterapia. Badania wskazują, że preparaty z odpowiednio dobranymi, przebadanymi klinicznie szczepami probiotycznymi mogą zwiększać różnorodność mikrobioty, a także modulować ich aktywność metaboliczną. Ponadto korygowanie dysbiozy jelitowej za pomocą synbiotyków może być skuteczniejsze niż suplementacja samymi probiotykami, ponieważ obecność prebiotyków wspiera wzrost i przeżycie zawartych w preparacie szczepów [11].
W badaniu Jancza A. i wsp. (2020) przeanalizowano wpływ suplementacji synbiotykiem (był to polski produkt Sanprobi Super Formula) na modulację mikrobioty i wspomaganie bariery jelitowej u osób z nadmierną masą ciała. W grupie otrzymującej synbiotyk (czyli probiotyk + prebiotyk) odnotowano wzrost wskaźników różnorodności, a także zmniejszenie stężenia zonuliny będącej markerem bariery jelitowej [12].
Kolejne badanie Barreto i wsp. (2014) wykazało, że szczep Lactobacillus plantarum W21 przyjmowany przez kobiety w wieku postmenopauzalnym obniżał stężenie glukozy oraz homocysteiny w porównaniu do efektów obserwowanych w grupie placebo. Ciekawych wniosków dostarczyło także badanie Moroti i wsp. (2012), które z kolei wykazało wpływ szczepu Lactobacillus acidophilus W22 w regulacji gospodarki lipidowej [13,14].
Stosowanie probiotyków jest także uzasadnione w przypadki nadmiernej masy ciała w przebiegu PCOS (zespół policystycznych jajników) – ten temat szerzej opisałam tutaj (klik).
Czasowa suplementacja poprzez odpowiednią modulację mikrobioty może zwiększać jej bioróżnorodność, a tym samym zmniejszać stan zapalny, przywracać prawidłową pracę bariery jelitowej i usprawniać regulację przemian metabolicznych.
Mikrobiota a rytm dobowy, czyli o korzyściach z jedzenia w wąskich wycinkach doby
Ciekawostką, którą chciałabym się z Wami podzielić przy okazji tego tematu jest wpływ rytmu dobowego na funkcje mikrobioty. Na podstawie badań przedklinicznych okazuje się, że spożywanie pokarmów w określonych „oknach czasowych” może przyczyniać się do zróżnicowania mikrobioty jelitowej, a także jej aktywności metabolicznej.
Badane myszy miały nieograniczony dostęp do pokarmu, ale w wąskim odcinku doby (poniżej 12 godzin dziennie). Następnie przechodziły w fazę postu. Mimo braku restrykcji kalorycznej i obecnych w diecie pokarmów wysokocukrowych i wysokotłuszczowych (!), odnotowano zmniejszenie insulinooporności, zmniejszenie tkanki tłuszczowej oraz redukcję stanu zapalnego. Zwiększyła się także różnorodność mikrobioty i spadek liczebności mikrobów związanych z otyłością, co wskazuje, że nie tylko jakość, ale także czas i pora spożywania posiłku w ciągu doby może wywierać znaczący wpływ na metabolizm i skład mikrobioty. Mimo obiecujących wyników badań, pozostaje nam czekać na większe, dobrze zaprojektowane badania kliniczne [15, 16, 17].
Podsumowanie
Otyłość jest globalnym problemem zdrowotnym, któremu towarzyszy przewlekły stan zapalny, a pokłosiem są zaburzenia i choroby o podłożu metabolicznym: insulinooporność, cukrzyca typu 2 czy dyslipidemia. Na podstawie wielu badań wiemy dziś, że w rozwoju otyłości bierze udział także mikrobiota jelitowa. Wysokoprzetworzona dieta, niska aktywność fizyczna, chroniczny stres, a także niektóre leki prowadzą do dysbiozy i nasilenia endotoksemii.
Podstawą modulowania „warunków bytowych” naszej jelitowej społeczności jest różnorodna dieta bazująca na produktach przeciwzapalnych, bogata w prebiotyki, błonnik i polifenole z produktów roślinnych (za najzdrowszą dietę na świecie uznawana jest obecnie dieta śródziemnomorska). Warto korzystać z sezonowych, lokalnych warzyw i owoców, a także zadbać o prawidłową podaż zdrowych tłuszczów i pełnoziarnistych produktów. Warto zaznaczyć, że wszelkie eliminacje pokarmów niosą za sobą ryzyko zubożenia ekosystemu jelitowego, dlatego powinny być podyktowane konkretnym wskazaniem przez specjalistę. Podobnie diety niskowęglowodanowe niosą ryzyko zaburzeń w obrębie mikrobioty, dlatego wszelkie modyfikacje żywieniowe warto przepracować ze swoim dietetykiem.
Probiotykoterapia stanowi cenne wsparcie dietoterapii pod warunkiem stosowania preparatów o udokumentowanej skuteczności klinicznej w kontekście różnicowania naturalnej mikrobioty, zmniejszania stanów zapalnych, a także utrzymywania prawidłowych funkcji układu odpornościowego.
Wpis powstał we współpracy z partnerem merytorycznym Sanprobi.
Nagrałam odcinek video na temat roli mikrobioty i stosowania probiotyków w rozwoju otyłości z dietetyczką, specjalistką od jelit Emilią Cesarek. Jeżeli masz ochotę zapraszam do odsłuchu! (klik)
Bibliografia:
- Marlicz W., Ostrowska L., Łoniewski I. Flora bakteryjna jelit i jej potencjalny związek z otyłością. Endokrynologia, Otyłość i Zaburzenia Przemiany Materii 2013; 9: 20–28.
- Dziewiatowska J. i wsp. Związek pomiędzy mikroflorą jelitową a otyłością. Forum Zaburzeń Metabolicznych 2014, tom 5, nr 1, 20–25
- Huh S., Rifas-Shiman S., Zera C. i wsp.: Delivery by cesarean section and risk of obesity in preschool age children: a prospective cohort study. Arch. Dis. Child. 2012; 97: 610–616.
- Pokrzywnicka P, Gumprecht J. Intestinal microbiota and its relationship with diabetes and obesity. Clin Diabetol 2016; 5, 5: 164–172.
- Chwalba A, Otto-Buczkowska E. Participation of the microbiome in the pathogenesis of diabetes mellitus. Clin Diabetol 2017; 6, 5: 178–181
- Góralska M. i wsp. Mechanizmy immunologiczne towarzyszące otyłości i ich rola w zaburzeniach metabolizmu. Postepy Hig Med Dosw (online), 2015; 69: 1384-1404
- Dróżdż J. Kołaczkowska E. Otyłość jako rodzaj przewlekłego zapalenia, Wszechświat, t. 112, nr 10-12/2011
- Schwiertz A., Taras D., Schäfer K. i wsp.: Microbiota and SCFA In lean and overweight healthy subjects. Obesity 2010; 18: 190–195.
- Sergeev IN, Aljutaily T, Walton G, Huarte E. Effects of Synbiotic Supplement on Human Gut Microbiota, Body Composition and Weight Loss in Obesity. Nutrients. 2020 Jan 15;12(1):222.
- Fan FY, Sang LX, Jiang M. Catechins and Their Therapeutic Benefits to Inflammatory Bowel Disease. Molecules. 2017 Mar 19;22(3):484.
- Sergeev IN, Aljutaily T, Walton G, Huarte E. Effects of Synbiotic Supplement on Human Gut Microbiota, Body Composition and Weight Loss in Obesity. Nutrients. 2020 Jan 15;12(1):222.
- Janczy A, Aleksandrowicz-Wrona E, Kochan Z, i wsp. Impact of diet and synbiotics on selected gut bacteria and intestinal permeability in individuals with excess body weight – A Prospective, Randomized Study. Acta Biochim Pol. 2020 Dec 16;67(4):571-578.
- Barreto FM, Colado Simão AN, Morimoto HK, Batisti Lozovoy MA, Dichi I, Helena da Silva Miglioranza L. Beneficial effects of Lactobacillus plantarum on glycemia and homocysteine levels in postmenopausal women with metabolic syndrome. Nutrition. 2014 Jul-Aug;30(7-8):939-42.
- Moroti C, Souza Magri LF, de Rezende Costa M, Cavallini DC, Sivieri K. Effect of the consumption of a new symbiotic shake on glycemia and cholesterol levels in elderly people with type 2 diabetes mellitus. Lipids Health Dis. 2012 Feb 22;11:29.
- Kaczmarek JL, Thompson SV, Holscher HD. Complex interactions of circadian rhythms, eating behaviors, and the gastrointestinal microbiota and their potential impact on health. Nutr Rev. 2017;75(9):673-682.
- Chaix A, Manoogian ENC, Melkani GC, Panda S. Time-Restricted Eating to Prevent and Manage Chronic Metabolic Diseases. Annu Rev Nutr. 2019 Aug 21;39:291-315.
- Chaix A, Zarrinpar A. The effects of time-restricted feeding on lipid metabolism and adiposity. Adipocyte. 2015 Apr 20;4(4):319-24.


